該來的總要來,CFDA8月11日關于生産工藝自查的新(xīn)聞再次刷爆朋友圈。PS:新(xīn)手請備好尿壺,老人們早已長(cháng)年穿着尿不濕。CFDA一忙,藥企就要跟着更忙了。
我們對比了一下,征求意見稿與此前無碼流出版的差别。這一版有了更加科(kē)學(xué)的修正,主要有以下變化:
1
标題即變幻風格
标題由《關于進一步加強藥品生産工藝監管的公告》變為(wèi)《關于開展藥品生産工藝核對工作(zuò)的公告》。
原文(wén)為(wèi)“監管”,變更為(wèi)“核對”,行文(wén)的主體(tǐ)發生變化,由面向監管方的管理(lǐ)口吻變為(wèi)面向藥品生産企業的公告。
新(xīn)版标題也放棄了使用(yòng)“自查”、“核查”這種嚴厲威懾恐怖的字眼,變得用(yòng)詞溫柔考究。不恰當的比愉,政府監管者的形象由嚴肅的行業法官,轉變為(wèi)溫婉爾雅的舉牌女郎。有人說,這明顯是婆婆變媽媽,注意,不要挑撥民(mín)事矛盾。
這種調整,看似無足輕重,但背後體(tǐ)現的是政府職能(néng)由管理(lǐ)向服務(wù)轉變的思路。這種轉變,不僅體(tǐ)現于一規一文(wén),對行業的影響會比較深遠(yuǎn),意義重大。
2
背景緩緩導入
開篇新(xīn)增了政策導入描述,背景音樂響起,主持人婉轉介紹背景,循序漸進,避免被不懂裝(zhuāng)懂的吃瓜媒體(tǐ)報道而引起民(mín)衆恐慌。這一點是相當英明的。
新(xīn)增“藥品生産工藝是持續穩定地生産出合格藥品的過程和方法,按照監管部門批準的生産工藝組織生産是保障藥品質(zhì)量的前提。為(wèi)加強藥品生産工藝管理(lǐ),原國(guó)家食品藥品監督管理(lǐ)局于2007年8月部署開展了注射劑類藥品生産工藝和處方核查工作(zuò),各省局對企業申報登記的生産工藝等相關資料進行了審查,初步建立了注射劑生産工藝等資料檔案。2007年10月修訂實施的《藥品注冊管理(lǐ)辦法》規定批準藥品上市前應進行生産現場檢查,保障了技(jì )術審評部門核定的生産工藝的可(kě)行性,此後批準上市的絕大多(duō)數藥品的實際生産工藝與批準的生産工藝是一緻的。近年來,食品藥品監管部門在監督檢查中發現仍有部分(fēn)2007年前批準上市的品種未按照批準的生産工藝組織生産、改變生産工藝不按規定研究和申報。為(wèi)此,總局決定開展藥品生産工藝核對工作(zuò)。”
這段小(xiǎo)詞說得真考究漂亮,清晰地給我們描述了一幅由遠(yuǎn)漸進的畫面,體(tǐ)現了監管工作(zuò)的持續連貫、不斷加強。
對用(yòng)藥安(ān)全影響較大的注射劑,2007通過8月就已經開展核查了嘛。然後,進一步框定範圍,2007年10月修訂的注冊辦法之後,我們是一直保持嚴格審評、現場檢查狀态,這些品種也是管理(lǐ)得不錯滴,老百姓們不必害怕。
随後話鋒一轉,近年來,我們還是發現了部分(fēn)老品種存在私自改動工藝情況,2007年前上市的部分(fēn)老品種哦。
看完這一段,吃瓜群衆驚呆張大的嘴已經可(kě)以慢慢閉上,繼續咀嚼吃瓜。
3
有收有放,時限提前
原方案為(wèi)2016年12月31日之前完成自查,一刀(dāo)切。而現在調整為(wèi)“藥品生産企業應于2016年10月1日前完成自查并将自查情況報所在地省級食品藥品監管部門。省級食品藥品監管部門應對企業自查情況進行彙總,填寫自查情況彙總表并于2016年11月1日前上報食品藥品監管總局”。
對發生工藝變更的,也區(qū)分(fēn)了在産品種與暫不生産品種,拉開時限差,避免不生産品種也紮堆湊熱鬧,比較科(kē)學(xué)。“2017年6月30日前完成在産品種生産工藝的研究驗證、提交備案或補充申請等相關工作(zuò),其他(tā)暫不生産品種應于2017年12月31日前完成上述工作(zuò)”。
4
柔性停産,不再驚人的一刀(dāo)切
原方案“實際生産工藝與核準批準生産工藝不一緻的,應立即停止生産或進口”,這一條最驚悚。如果按這個來執行,不能(néng)排除不少大品種出現熔斷式斷片。
新(xīn)方案中,按工藝變更是否對産品質(zhì)量産生影響而區(qū)分(fēn),“經研究驗證,生産工藝變化對藥品質(zhì)量産生影響的,企業應立即停産”,生産工藝變化對質(zhì)量不産生影響的,可(kě)以繼續生産。
新(xīn)方案尤其增加了兩條例外,相信很(hěn)多(duō)人看完之後,長(cháng)舒一口氣,這泡尿可(kě)以舒心地尿出來了。久病不起的患者也是這樣閉眼的。
第一條例外是,我是2007年前就違規改動工藝的,改了之後一直就這樣幹,幹了至少10年,産品質(zhì)量可(kě)控,安(ān)全有效,今天可(kě)以不停産。呼啦啦,過來一群群衆,都舉着胳膊呼喊,我們都是這麽幹的!!
第二條例外是,變更的工藝屬于技(jì )術進步或創新(xīn)的,可(kě)以不停産。嘩啦啦,同樣一波群衆又過來了,我們都是這麽幹的!!
……
PS:
1、躲過10年監管,一直違規生産,終有合法一天。被逼上任的質(zhì)量授權人,可(kě)以睡安(ān)穩覺了。
2、10年工藝不變更,不管是不是合法,時間也挺長(cháng)了。
3、但凡變更,都是為(wèi)了質(zhì)量可(kě)控、安(ān)全有效,基本也都是技(jì )術進步。有人傻到把工藝變不穩定,安(ān)全變危險嗎?
5
弱化了外企
民(mín)間版中提到了藥品生産企業,含境外制藥廠商,本版中特意删掉了。在正文(wén)的多(duō)處描述中,如程序,都是盯住了内資企業的。雖說外企也可(kě)以按照《藥品注冊管理(lǐ)辦法》中的要求進行補充申請,但明顯沒有文(wén)字提及。
在時限管理(lǐ)上,“藥品生産企業應于2016年10月1日前完成自查并将自查情況報所在地省級食品藥品監管部門。省級食品藥品監管部門應對企業自查情況進行彙總,填寫自查情況彙總表并于2016年11月1日前上報食品藥品監管總局”,明顯不是針對外企。
6
生産工藝自查邏輯圖
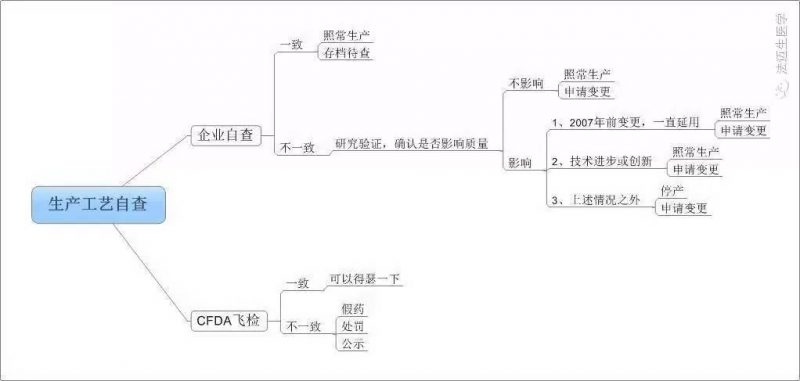
不多(duō)說,來看看流出版與征求意見版的全文(wén)比對吧,注:紅色為(wèi)原版文(wén)字描述,藍字為(wèi)新(xīn)增文(wén)字。
關于進一步加強開展藥品生産工藝監管核對工作(zuò)的公告
(征求意見稿)
根據藥品監督檢查信息,部分(fēn)藥品生産企業存在不按照食品藥品監管部門核準的生産工藝生産藥品的問題。為(wèi)進一步規範藥品生産秩序,解決藥品生産企業不按照核準生産工藝生産藥品、變更生産工藝不按規定研究和申報的問題,現就有關事項公告如下:
藥品生産工藝是持續穩定地生産出合格藥品的過程和方法,按照監管部門批準的生産工藝組織生産是保障藥品質(zhì)量的前提。為(wèi)加強藥品生産工藝管理(lǐ),原國(guó)家食品藥品監督管理(lǐ)局于2007年8月部署開展了注射劑類藥品生産工藝和處方核查工作(zuò),各省局對企業申報登記的生産工藝等相關資料進行了審查,初步建立了注射劑生産工藝等資料檔案。2007年10月修訂實施的《藥品注冊管理(lǐ)辦法》規定批準藥品上市前應進行生産現場檢查,保障了技(jì )術審評部門核定的生産工藝的可(kě)行性,此後批準上市的絕大多(duō)數藥品的實際生産工藝與批準的生産工藝是一緻的。近年來,食品藥品監管部門在監督檢查中發現仍有部分(fēn)2007年前批準上市的品種未按照批準的生産工藝組織生産、改變生産工藝不按規定研究和申報。為(wèi)此,總局決定開展藥品生産工藝核對工作(zuò)。現就有關事項公告如下:
一、藥品生産企業(含境外制藥廠商,下同)作(zuò)為(wèi)承擔藥品質(zhì)量第一責任人安(ān)全的主體(tǐ)責任,必須嚴格按照食品藥品監管部門核準批準的生産工藝組織生産。藥品生産企業改變已批準的生産工藝,必須經過充分(fēn)的研究和驗證,并按照《藥品注冊管理(lǐ)辦法》的有關規定提交藥品注冊補充申請。
二、自本公告發布之日起,藥品生産企業應對每個批準上市藥品的生産工藝(中藥為(wèi)制法,下同)開展自查,排除質(zhì)量安(ān)全隐患。
二、三、自查内容為(wèi)藥品的實際生産工藝與報經食品藥品監管部門核準批準的生産工藝是否一緻。食品藥品監管部門核準批準的生産工藝包括批準審批藥品生産申請時核準批準的生産工藝及批準審批相關補充申請時核準批準的生産工藝。
三、四、藥品生産企業應于2016年10月1日前完成自查并将自查情況報所在地省級食品藥品監管部門。省級食品藥品監管部門應對企業自查情況進行彙總,填寫自查情況彙總表(附件1)并于2016年11月1日前上報食品藥品監管總局。
五、藥品生産企業根據自查結果,應分(fēn)别采取以下處理(lǐ)措施。:
(一)實際生産工藝與核準批準生産工藝一緻,、能(néng)夠保證藥品質(zhì)量的,相關藥品生産企業可(kě)以繼續生産或進口,并應将自查情況報告與藥品生産工藝報所在地省級食品藥品監管部門備案;進口藥品生産工藝報食品藥品監管總局受理(lǐ)與舉報中心(以下簡稱“受理(lǐ)中心”)備案,受理(lǐ)中心應在受理(lǐ)後5日内将申報等資料送交食品藥品監管總局審核查驗中心一并歸檔,作(zuò)為(wèi)監管部門開展日常監管、現場核查的備查資料。
(二)實際生産工藝與核準批準生産工藝不一緻的,應立即停止生産或進口。相關藥品生産企業應按照《藥品生産質(zhì)量管理(lǐ)規範》《藥品注冊管理(lǐ)辦法》補充申請事項的相關要求以及《已上市中藥變更研究技(jì )術指導原則(一)》、《已上市化學(xué)藥品變更研究的技(jì )術指導原則(一)》、《生物(wù)制品生産工藝過程變更管理(lǐ)技(jì )術指導原則》等相關技(jì )術要求開展充分(fēn)的研究驗證。
1.經研究驗證,生産工藝變化對藥品安(ān)全性、有效性和質(zhì)量可(kě)控性不産生影響的,藥品生産企業應将生産工藝及相關資料報所在地省級食品藥品監管部門備案後方可(kě)繼續生産,進口藥品生産工藝報食品藥品監管總局受理(lǐ)中心備案後方可(kě)繼續進口。受理(lǐ)中心應在受理(lǐ)後5日内将申報資料送交食品藥品監管總局審核查驗中心。
2.經研究驗證,生産工藝變化對藥品安(ān)全性、有效性和質(zhì)量可(kě)控性質(zhì)量不産生影響的,藥品生産企業應按照《藥品注冊管理(lǐ)辦法》附件4的要求第18項提出“改變影響藥品質(zhì)量的生産工藝”補充申請,申報資料要求見附件2。省級食品藥品監管部門或食品藥品監管總局受理(lǐ)與舉報中心于受理(lǐ)後無需實施現場核查及抽樣檢驗,并于5日内将申報資料送交國(guó)家食品藥品監督管理(lǐ)總局藥品審評中心(以下簡稱“藥審中心”)。藥審中心應在收到藥審中心依據《藥品注冊管理(lǐ)辦法》開展技(jì )術審評,必要時可(kě)以要求申請人補充資料,所需時間不計入技(jì )術審評時限。國(guó)家食品藥品監督管理(lǐ)總局依據《藥品注冊管理(lǐ)辦法》作(zuò)出審批決定。
經研究驗證,生産工藝變化對藥品質(zhì)量産生影響的,企業應立即停産。藥品生産企業應按照《藥品注冊管理(lǐ)辦法》附件4第7項提出“改變影響藥品質(zhì)量的生産工藝”補充申請。省級食品藥品監管部門于受理(lǐ)後5日内将申報資料送交藥審中心。藥審中心應組織專門審評力量、建立單獨審評通道,于收到申報資料後30日内完成技(jì )術審評,必要時可(kě)以要求申請人補充資料,所需時間不計入技(jì )術審評時限。國(guó)家食品藥品監督管理(lǐ)總局應在5日内完成行政審批。補充申請獲批後,藥品生産企業方可(kě)繼續生産或進口。
四、藥品生産企業應于2016年12月31日前完成上述自查、2017年6月30日前完成在産品種生産工藝的研究驗證、提交備案或補充申請等相關工作(zuò),其他(tā)暫不生産品種應于2017年12月31日前完成上述工作(zuò);未按時完成的,應暫停生産或進口。國(guó)産藥品和進口藥品的生産工藝備案分(fēn)别按照《藥品注冊管理(lǐ)辦法》附件4的補充申請事項第36項和第18項提交,申報資料要求見附件1停止生産。
五、2017年3六、2016年11月1日起,國(guó)家食品藥品監督管理(lǐ)總局将組織專家對藥品生産企業開展飛行檢查。檢查中發現實際生産工藝與食品藥品監管部門備案或核準批準的生産工藝不一緻的,其所生産的藥品按假藥論處,将依據《中華人民(mín)共和國(guó)藥品管理(lǐ)法》第七十三第四十八條第二款的有關規定,其所生産的藥品按假藥論處。藥監部門将依據《中華人民(mín)共和國(guó)藥品管理(lǐ)法》第七十四條的有關規定對涉事藥品生産企業進行處罰,并向社會公開相關藥品生産企業企業法定代表人和相關責任人員。
六、依據《已上市中藥變更研究技(jì )術指導原則(一)》、《已上市化學(xué)藥品變更研究的技(jì )術指導原則(一)》、《生物(wù)制品生産工藝過程變更管理(lǐ)技(jì )術指導原則》,不影響安(ān)全性、有效性和質(zhì)量可(kě)控性的變更,主要包括中藥、化學(xué)藥品I類和Ⅱ類變更,生物(wù)制品Ⅲ類變更。影響安(ān)全性、有效性和質(zhì)量可(kě)控性的變更,主要包括中藥、化學(xué)藥品Ⅲ類變更,生物(wù)制品I類和Ⅱ類變更等。具體(tǐ)見附件2。七、發生過影響藥品質(zhì)量的生産工藝變更,但生産企業能(néng)夠确保産品安(ān)全有效的,符合下列情形的,可(kě)以暫不停産,但需要按本公告要求提出相關補充申請。
(一)相關品種在《藥品注冊管理(lǐ)辦法》2007年修訂實施前已經發生影響藥品質(zhì)量的生産工藝變更,此後一直正常生産,生産工藝穩定且未發現安(ān)全性和有效性問題的;
(二)相關品種發生影響藥品質(zhì)量的生産工藝變更,變更後的生産工藝屬于技(jì )術進步或創新(xīn)的。
八、本公告自發布之日起實施,進口藥品參照執行。
特此公告。
